Estructura del átomo
Un átomo está formado por dos partes esenciales: un núcleo central con carga eléctrica positiva y unas partículas con carga negativa que giran a su alrededor.
El núcleo alberga dos tipos de partículas: los protones, con carga positiva, y los neutrones, que no tienen carga eléctrica.
Rodeando al núcleo se encuentran los electrones, partículas diminutas con carga negativa.

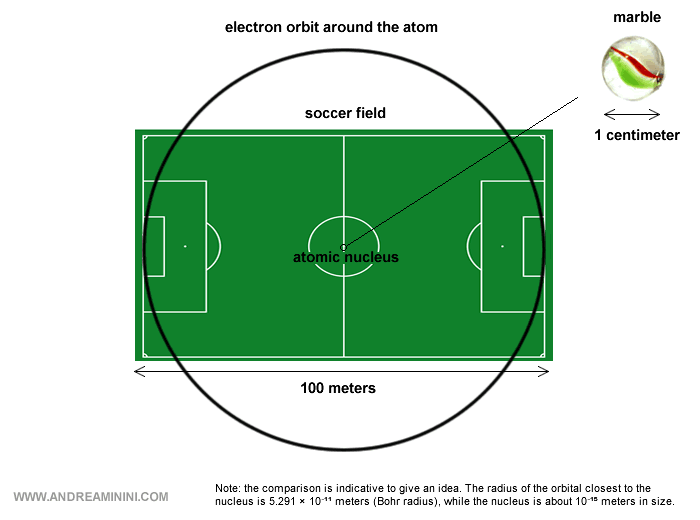
Para hacernos una idea de las proporciones: el núcleo es minúsculo en comparación con el átomo completo, ya que ocupa solo una fracción ínfima de su tamaño si tenemos en cuenta las órbitas electrónicas.
En consecuencia, la mayor parte de un átomo es, literalmente... espacio vacío.
Nota. Incluyendo las órbitas electrónicas, un átomo mide en torno a 10-10 metros de diámetro. El núcleo, en cambio, apenas alcanza los 10-15 metros. Dicho de otro modo, el núcleo es unas diez mil veces más pequeño que el átomo. Una buena comparación es colocar una canica en el centro de un campo de fútbol: la canica representa el núcleo y el campo -con todo su vacío- representa el átomo, el espacio por donde se mueven los electrones.
¿Cuántos protones, neutrones y electrones tiene un átomo?
En un átomo neutro, el número de protones es igual al de electrones.
Cuando ambas cantidades coinciden, la carga positiva de los protones queda exactamente compensada por la carga negativa de los electrones.
El número de protones se denomina número atómico, y se representa con la letra Z. Es un dato fundamental porque determina de qué elemento químico se trata.
Ejemplo. El hidrógeno es el elemento más ligero y abundante del universo, presente en el agua y en las estrellas. Siempre posee un protón, por lo que su número atómico es Z=1. El carbono tiene siempre 6 protones, por lo tanto Z=6. El oxígeno cuenta siempre con 8 protones, de modo que Z=8, y así sucesivamente.

El número atómico (Z) no debe confundirse con el número másico (A), que resulta de sumar protones (Z) y neutrones (N) en el átomo.
A = Z + N
Ejemplo. El carbono siempre tiene Z = 6 protones, pero puede presentar 6 neutrones (A = 12, carbono-12) o 7 neutrones (A = 13, carbono-13). En ambos casos sigue siendo carbono.
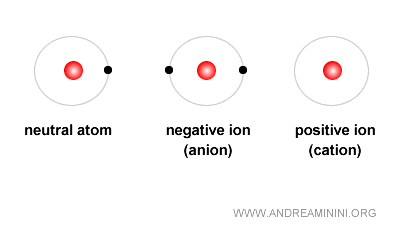
El caso de los iones
Cuando el número de protones y electrones es idéntico, las cargas se neutralizan y el átomo es estable. Pero si este equilibrio se rompe, el átomo se transforma en un ión.
- Ión positivo (catión): aparece cuando hay más protones que electrones.
- Ión negativo (anión): aparece cuando hay más electrones que protones.
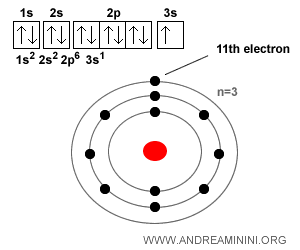
Ejemplo. Un átomo de sodio ($Na$) tiene 11 electrones cuando es neutro, ya que su número atómico Z es 11 (es decir, 11 protones y, por lo tanto, 11 electrones). Su configuración electrónica es: $$ 1s^2 \; 2s^2 \; 2p^6 \; 3s^1 $$ Así, posee 2 electrones en la primera capa, 8 en la segunda y solo 1 en la tercera (la capa externa). Ese electrón externo se pierde con gran facilidad, lo que explica que el sodio forme tan fácilmente el catión $Na^+$. Por la misma razón se une con tanta facilidad a un ión cloruro ($Cl^-$) para dar lugar al cloruro de sodio $Na^+Cl^-$, más conocido como sal de mesa.
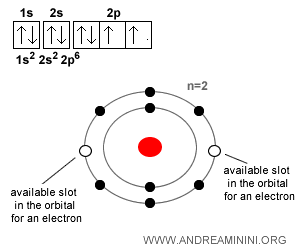
Veamos otro caso. El oxígeno ($O$), con Z = 8, tiene 8 protones y 8 electrones cuando es neutro. Sin embargo, tiende a captar dos electrones adicionales para completar su octeto y alcanzar estabilidad, formando así el ión óxido ($O^{-2}$). En su segundo nivel de energía ($n=2$), dos de las ocho posiciones disponibles permanecen vacías. Completar este “octeto” proporciona al átomo mayor estabilidad, y por eso el oxígeno suele captar dos electrones y convertirse en un anión.
¿Y qué ocurre con los neutrones?
Para determinar cuántos neutrones (N) posee un átomo, basta conocer su número atómico (Z) y su número másico (A).
N = A - Z
En otras palabras, el número de neutrones se obtiene restando el número atómico al número másico.
La identidad de un elemento no viene dada por los neutrones, sino exclusivamente por el número de protones, es decir, por Z.
Los neutrones, no obstante, sí influyen en la masa del átomo y resultan decisivos en el fenómeno de los isótopos.
¿Qué es un isótopo? Los isótopos son átomos de un mismo elemento químico -es decir, con el mismo número atómico Z (igual número de protones)- que difieren en la cantidad de neutrones (N) y, por consiguiente, en su masa. En resumen, los isótopos son variantes de un mismo elemento: comparten el número atómico, pero presentan masas distintas. El término "isótopo" se debe a que ocupan la misma posición que el elemento en la tabla periódica. Así, el hidrógeno (H) en su forma más común tiene un protón y un electrón, pero ningún neutrón. También puede aparecer como deuterio, con un protón, un electrón y un neutrón, o como tritio, con un protón, un electrón y dos neutrones. Los tres son isótopos del hidrógeno.
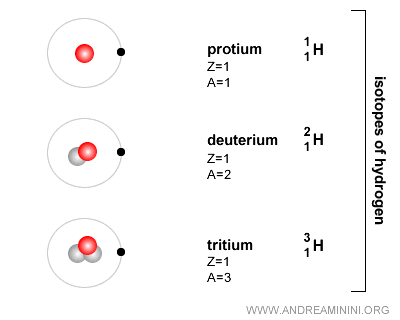
Al no tener carga eléctrica, los neutrones no alteran el estado eléctrico del átomo.
Lo que sí condicionan, en cambio, es un aspecto crucial: la estabilidad del núcleo.
Un átomo se considera estable cuando su núcleo no se transforma de manera espontánea en otro distinto.
Ahora bien, no todos los núcleos son estables: algunos resultan inestables y, con el tiempo, se desintegran liberando radiación hasta convertirse en formas más estables.
Precisamente esta inestabilidad nuclear es el origen de fenómenos como la radiactividad.
Ejemplo. El carbono-12, con 6 protones y 6 neutrones, es estable y constituye la base esencial de la vida.
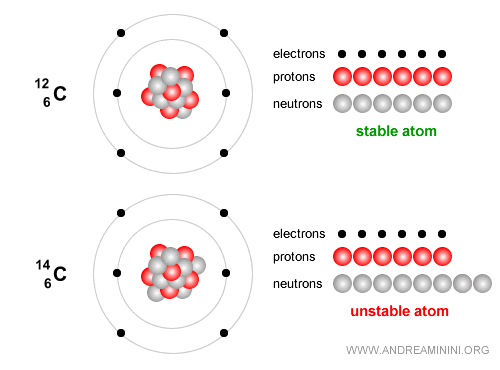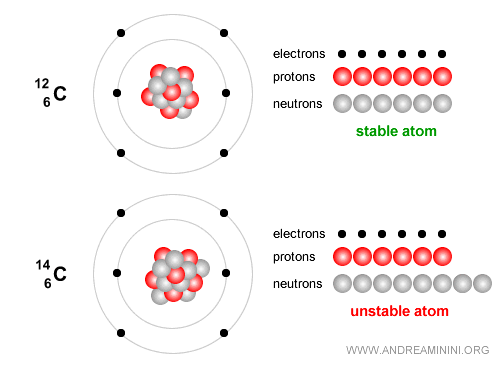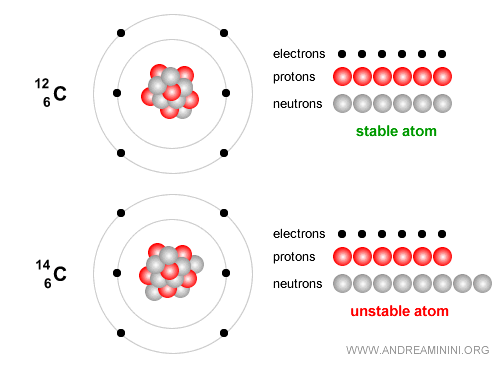
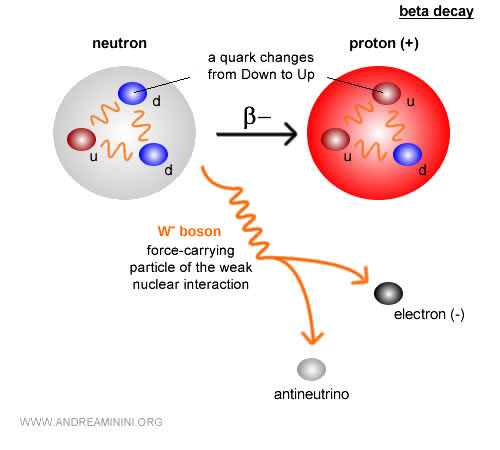
En cambio, el carbono-14 es un isótopo inestable que se desintegra lentamente y se emplea ampliamente para datar restos arqueológicos y orgánicos de hasta unos 50.000 años. El carbono-14 tiene 6 protones y 8 neutrones. Con el tiempo experimenta desintegración beta ( $ β^- $ ): $$ {}^{14}_6 C \;\;\longrightarrow\;\; {}^{14}_7 N \;+\; e^- \;+\; \bar{\nu}_e $$ En términos sencillos, un neutrón del núcleo de carbono se transforma en un protón, emitiendo un electrón (partícula beta menos) y un antineutrino electrónico. El núcleo pasa entonces a ser nitrógeno-14 ($N$), que sí es estable.
La organización de los electrones
Los electrones no se mueven al azar en torno al núcleo: se distribuyen en regiones cuantizadas denominadas orbitales. Cada orbital representa una “nube de probabilidad” donde es más probable localizar al electrón.
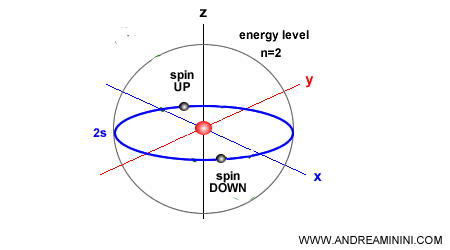
Un orbital puede contener, como máximo, dos electrones: uno con espín hacia arriba y otro con espín hacia abajo, en cumplimiento del principio de exclusión de Pauli.
Los orbitales atómicos se clasifican en cuatro tipos principales:
- s (esféricos)
- p (bilobulados)
- d (más complejos, habitualmente con cuatro o cinco lóbulos)
- f (de formas aún más elaboradas)
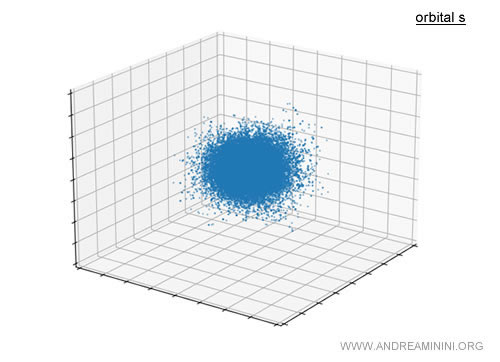
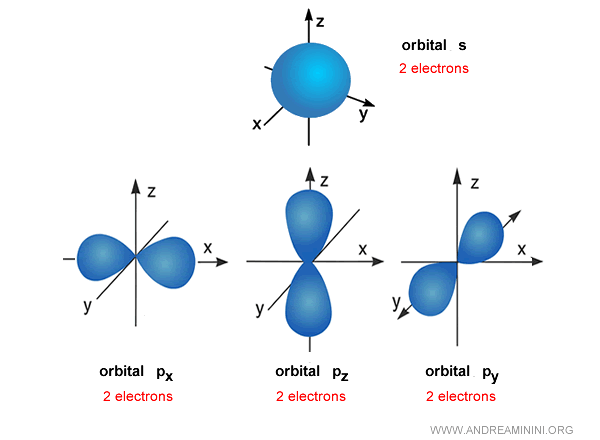
Por ejemplo, el orbital s es aproximadamente esférico en torno al núcleo.
En rigor, no se trata de una esfera sólida, sino de una nube de probabilidad que indica dónde es más factible hallar al electrón.
Los orbitales p, por su parte, se orientan a lo largo de tres ejes: $p_x$, $p_y$ y $p_z$.
Cada orbital p puede alojar hasta dos electrones.
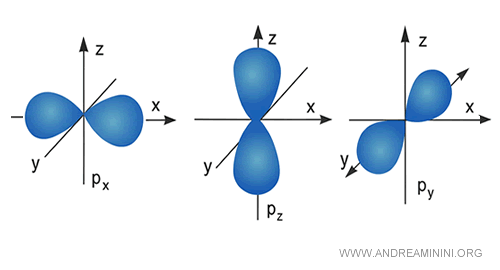
A medida que aumenta el nivel de energía, crece también el número de orbitales y sus formas se vuelven cada vez más complejas.
Los orbitales d, por ejemplo, suelen mostrar configuraciones de cuatro lóbulos, salvo una excepción con forma distinta.
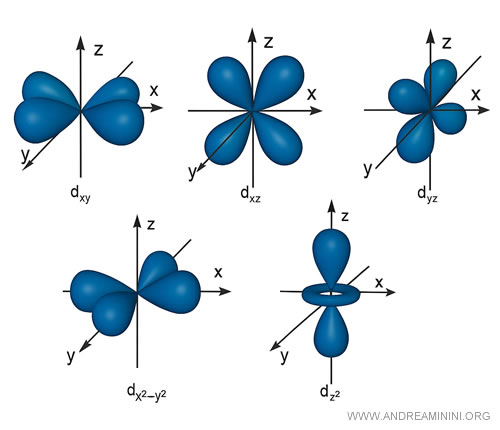
De nuevo, cada orbital no puede albergar más de dos electrones.
Ejemplo. El primer nivel de energía $n=1$ contiene un único orbital s, por lo que solo admite 2 electrones. El segundo nivel $n=2$ incluye un orbital s y tres orbitales p, en total cuatro orbitales y hasta 8 electrones -la base de lo que en química se conoce como la “regla del octeto”.
El tercer nivel $n=3$ consta de un orbital s, tres orbitales p y cinco orbitales d -9 orbitales en total, con capacidad para un máximo de 18 electrones-, y así sucesivamente. En esta imagen se representan los orbitales s, p, d y f a lo largo de los siete primeros niveles de energía.
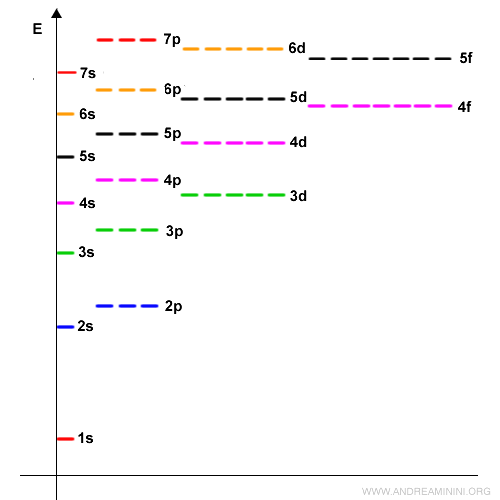
Conviene señalar que el orden de llenado no sigue siempre la secuencia de los números cuánticos principales $n$. Los electrones ocupan primero los orbitales de menor energía antes de pasar a los de mayor (este es el “principio de Aufbau”, del alemán “construir”). Así, tras completarse los orbitales $3p$, los electrones pasan al orbital $4s$ -ligeramente más bajo en energía que $3d$- aunque pertenezca a un nivel superior ($n=4$). Solo después se llenan los orbitales $3d$. En definitiva: el orden de llenado responde a la energía creciente de los orbitales $E$, no simplemente al número cuántico principal $n$.
Esta distribución electrónica es, en última instancia, la que determina las propiedades químicas de cada elemento.
Y más allá de este punto, el patrón continúa.