Structure de l’atome
Un atome se compose de deux parties essentielles : un noyau central chargé positivement et des particules de charge négative qui gravitent autour de lui.
Le noyau contient deux types de particules : les protons, porteurs d’une charge positive, et les neutrons, dépourvus de charge électrique.
Autour du noyau se déplacent les électrons, particules très légères dotées d’une charge négative.

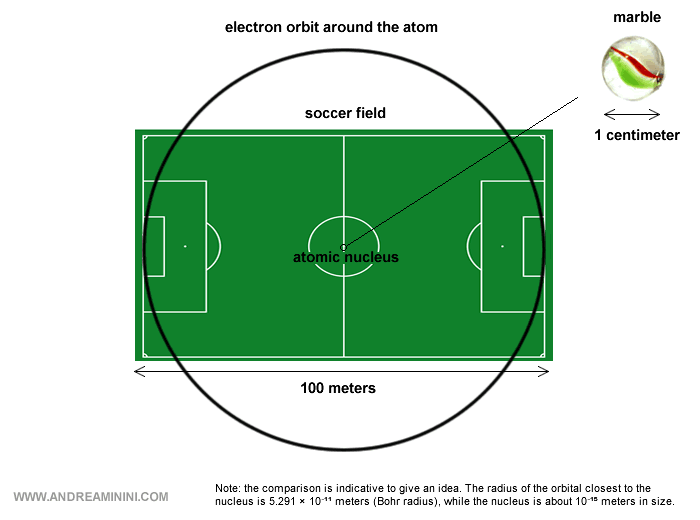
Pour donner un ordre de grandeur : le noyau est minuscule par rapport à l’ensemble de l’atome, puisqu’il n’occupe qu’une fraction infime de son volume si l’on tient compte des orbites électroniques.
En conséquence, la majeure partie d’un atome est, en réalité, du vide.
Remarque. En incluant les orbites électroniques, un atome mesure environ 10-10 mètres de diamètre, alors que le noyau n’atteint que 10-15 mètres. Autrement dit, le noyau est environ dix mille fois plus petit que l’atome. Une comparaison parlante consiste à imaginer une bille posée au centre d’un stade de football : la bille représente le noyau, et le stade - essentiellement vide - représente l’atome, l’espace où se meuvent les électrons.
Combien de protons, de neutrons et d’électrons dans un atome ?
Dans un atome neutre, le nombre de protons est égal à celui des électrons.
Lorsque ces deux quantités coïncident, la charge positive des protons est exactement compensée par la charge négative des électrons.
Le nombre de protons définit le numéro atomique, noté Z. C’est une donnée fondamentale, car elle caractérise l’élément chimique.
Exemple. L’hydrogène est l’élément le plus léger et le plus abondant de l’univers, présent à la fois dans l’eau et dans les étoiles. Il possède toujours un proton, son numéro atomique est donc Z = 1. Le carbone a toujours 6 protons (Z = 6), l’oxygène 8 (Z = 8), et ainsi de suite.

Il ne faut pas confondre le numéro atomique (Z) avec le nombre de masse (A), qui correspond à la somme des protons (Z) et des neutrons (N).
A = Z + N
Exemple. Le carbone possède toujours Z = 6 protons, mais il peut avoir 6 neutrons (A = 12, carbone-12) ou 7 neutrons (A = 13, carbone-13). Dans les deux cas, il s’agit bien de carbone.
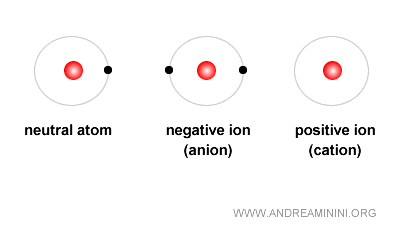
Le cas des ions
Lorsque le nombre de protons et d’électrons est identique, les charges se neutralisent et l’atome reste stable. Mais si cet équilibre est rompu, l’atome devient un ion.
- Ion positif (cation) : il apparaît lorsqu’il y a davantage de protons que d’électrons.
- Ion négatif (anion) : il apparaît lorsqu’il y a davantage d’électrons que de protons.
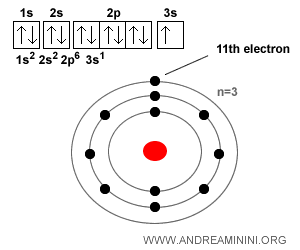
Exemple. Un atome de sodium ($Na$) possède 11 électrons lorsqu’il est neutre, car son numéro atomique est Z = 11 (soit 11 protons et donc 11 électrons). Sa configuration électronique est : $$ 1s^2 \; 2s^2 \; 2p^6 \; 3s^1 $$ Ce qui signifie 2 électrons sur la première couche, 8 sur la deuxième et un seul sur la troisième (la couche externe). Cet électron se perd très facilement, ce qui explique que le sodium forme aisément le cation $Na^+$. Pour la même raison, il se combine volontiers à un ion chlorure ($Cl^-$) pour donner le chlorure de sodium $Na^+Cl^-$, plus connu sous le nom de sel de table.
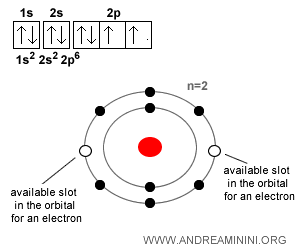
Prenons un autre exemple. L’oxygène ($O$), avec Z = 8, possède 8 protons et 8 électrons lorsqu’il est neutre. Cependant, il tend à capter deux électrons supplémentaires afin de compléter son octet et d’atteindre la stabilité, formant ainsi l’ion oxyde ($O^{2-}$). Sur son deuxième niveau d’énergie ($n=2$), deux cases restent vacantes. Le remplissage de cet « octet » confère à l’atome une stabilité supplémentaire, d’où la tendance de l’oxygène à capter deux électrons pour devenir un anion.
Et les neutrons ?
Pour connaître le nombre de neutrons (N) d’un atome, il suffit de disposer de son numéro atomique (Z) et de son nombre de masse (A).
N = A - Z
Autrement dit, on obtient N en soustrayant le numéro atomique du nombre de masse.
L’identité d’un élément ne dépend pas des neutrons mais uniquement du nombre de protons, c’est-à-dire de Z.
Les neutrons contribuent toutefois à la masse de l’atome et jouent un rôle essentiel dans l’existence des isotopes.
Qu’est-ce qu’un isotope ? On appelle isotopes les atomes d’un même élément chimique - donc ayant le même numéro atomique Z - qui diffèrent par leur nombre de neutrons (N), et donc par leur masse. En résumé, les isotopes partagent le même numéro atomique mais présentent des masses différentes. Le terme « isotope » signifie qu’ils occupent la même place dans le tableau périodique. Ainsi, l’hydrogène (H) le plus courant possède un proton et un électron, mais aucun neutron. Il existe aussi sous forme de deutérium (un proton, un électron et un neutron) et de tritium (un proton, un électron et deux neutrons). Ces trois formes sont des isotopes de l’hydrogène.
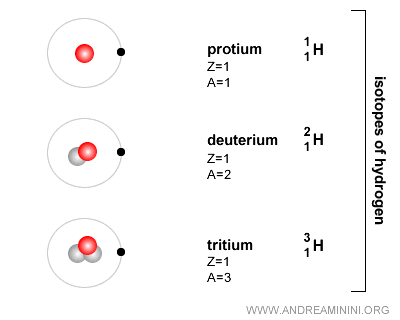
Neutres électriquement, les neutrons ne modifient pas la charge globale de l’atome.
En revanche, ils conditionnent un aspect déterminant : la stabilité du noyau.
Un noyau est dit stable lorsqu’il ne se transforme pas spontanément en un autre.
Or tous les noyaux ne le sont pas : certains sont instables et se désintègrent au fil du temps, émettant un rayonnement jusqu’à atteindre un état stable.
C’est cette instabilité nucléaire qui est à l’origine de la radioactivité.
Exemple. Le carbone-12, avec 6 protons et 6 neutrons, est stable et constitue la base de la vie.
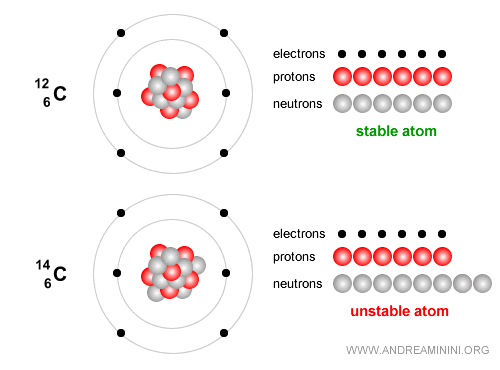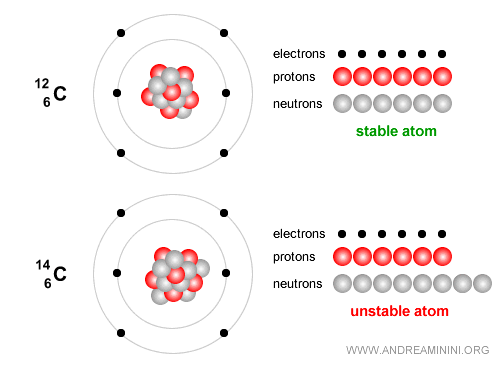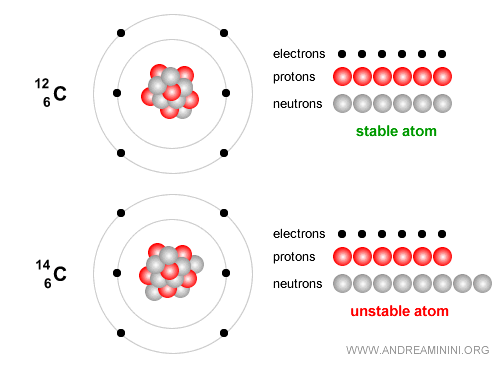
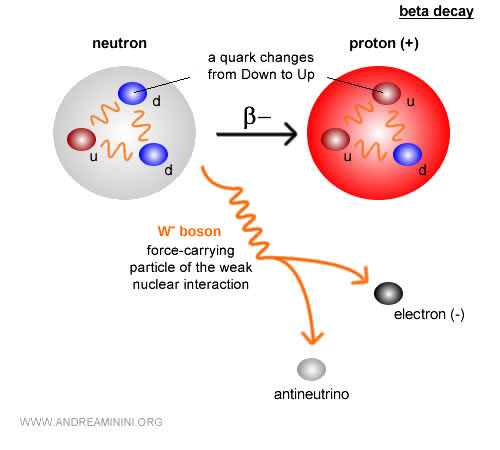
Le carbone-14, en revanche, est un isotope instable qui se désintègre lentement et sert à dater des restes archéologiques jusqu’à environ 50 000 ans. Il contient 6 protons et 8 neutrons. Avec le temps, il subit une désintégration bêta ($ β^- $) : $$ {}^{14}_6 C \;\;\longrightarrow\;\; {}^{14}_7 N \;+\; e^- \;+\; \bar{\nu}_e $$ En termes simples, un neutron du noyau de carbone se transforme en proton, tout en émettant un électron (particule bêta moins) et un antineutrino électronique. Le noyau devient alors de l’azote-14 ($N$), stable.
L’organisation des électrons
Les électrons ne se déplacent pas au hasard autour du noyau : ils se répartissent dans des régions quantifiées appelées orbitales. Une orbitale correspond à une « nappes de probabilité » où la présence de l’électron est la plus probable.
Chaque orbitale peut accueillir au maximum deux électrons : l’un avec un spin « up », l’autre avec un spin « down », selon le principe d’exclusion de Pauli.
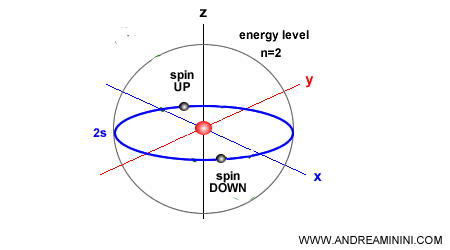
Les orbitales atomiques se divisent en quatre familles principales :
- s (sphériques)
- p (bilobées, en forme de haltères)
- d (plus complexes, généralement à quatre ou cinq lobes)
- f (encore plus élaborées)
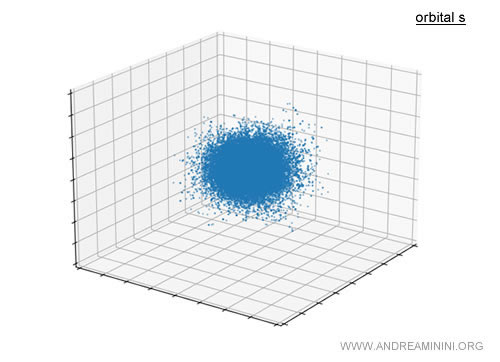
L’orbitale s est globalement sphérique autour du noyau.
Il ne s’agit pas d’une sphère solide mais d’un nuage de probabilité indiquant les zones où l’électron a le plus de chances de se trouver.
Les orbitales p s’orientent le long des trois axes : $p_x$, $p_y$ et $p_z$.
Chacune peut contenir jusqu’à deux électrons.
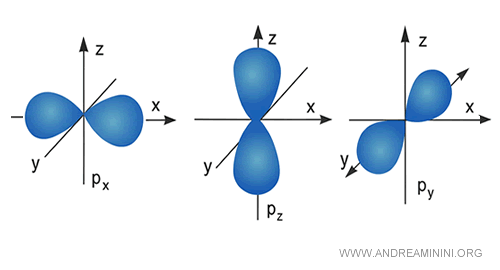
Au fur et à mesure que le niveau d’énergie augmente, le nombre et la complexité des orbitales croissent.
Les orbitales d, par exemple, présentent le plus souvent une structure à quatre lobes, sauf une exception de forme différente.
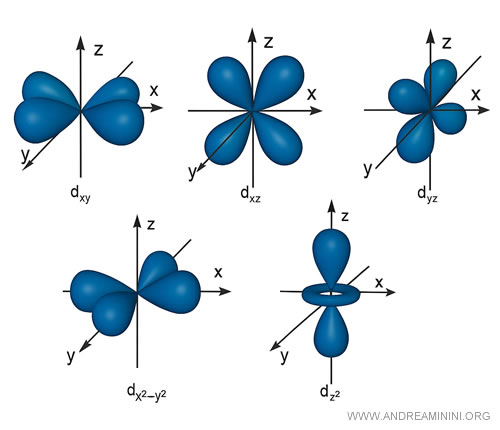
Là encore, chacune ne peut contenir plus de deux électrons.
Exemple. Le premier niveau d’énergie $n=1$ comporte une orbitale s, donc au maximum 2 électrons. Le deuxième niveau $n=2$ contient une orbitale s et trois orbitales p : quatre orbitales au total, pour un maximum de 8 électrons - à l’origine de la fameuse « règle de l’octet » en chimie.
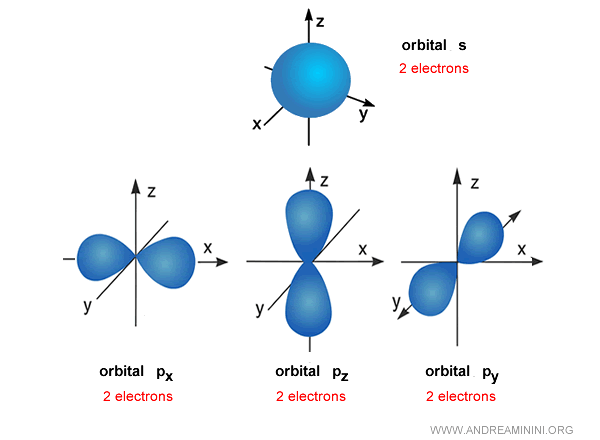
Le troisième niveau $n=3$ regroupe une orbitale s, trois orbitales p et cinq orbitales d - soit 9 orbitales, pouvant accueillir jusqu’à 18 électrons. L’illustration ci-dessous montre les orbitales s, p, d et f pour les sept premiers niveaux d’énergie.
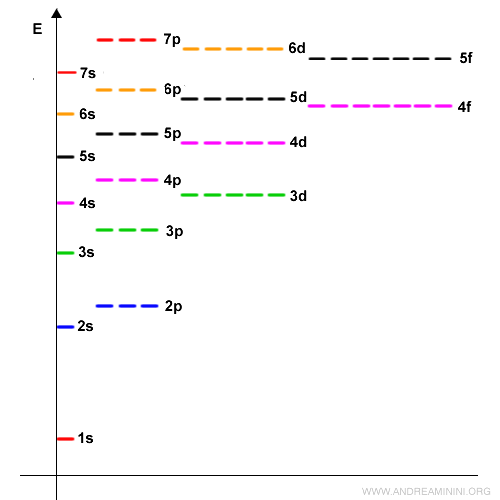
Il faut noter que l’ordre de remplissage ne suit pas strictement la valeur du nombre quantique principal $n$. Les électrons occupent d’abord les orbitales de plus basse énergie avant de remplir celles de plus haute (c’est le principe d’Aufbau, du mot allemand « construction »). Ainsi, après le remplissage des orbitales $3p$, les électrons passent à $4s$ - légèrement plus basse en énergie que $3d$ - bien qu’appartenant au niveau supérieur ($n=4$). Ce n’est qu’ensuite que se remplissent les orbitales $3d$. En somme, l’ordre de remplissage répond à la hiérarchie des énergies $E$, et non uniquement à la valeur de $n$.
Cette distribution électronique est, en dernier ressort, ce qui confère à chaque élément ses propriétés chimiques.
Et au-delà, le schéma se prolonge selon la même logique.