Principio de Pauli
Qué establece el Principio de Pauli
Dos electrones solo pueden ocupar un mismo orbital si presentan espines opuestos.
Por ello también se conoce como principio de exclusión: impide que dos electrones compartan exactamente el mismo estado cuántico.
Dado que el espín únicamente puede adoptar dos valores (arriba o abajo), cada orbital atómico puede albergar como máximo dos electrones.
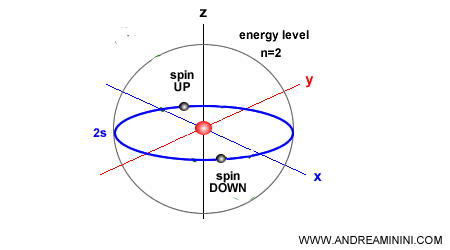
De ahí que, en ocasiones, se describa de manera informal como la regla de apareamiento electrónico.
Constituye, en definitiva, una de las normas básicas para determinar la configuración electrónica de los átomos.
¿Qué es el espín? El espín es uno de los números cuánticos fundamentales del electrón. Representa una propiedad intrínseca de la partícula que solo puede tomar dos valores: espín arriba (+½) y espín abajo (−½). Aunque suele ilustrarse como un giro de la partícula sobre sí misma, en realidad se trata de una magnitud puramente cuántica sin equivalente clásico.
En un sentido más amplio, el principio de exclusión de Pauli se aplica a todos los fermiones: partículas con espín semientero que ocupan estados cuánticos antisimétricos.
Ningún par de fermiones idénticos puede encontrarse simultáneamente en el mismo estado cuántico.
El principio se extiende, por tanto, más allá de los electrones e incluye protones, neutrones y el resto de fermiones.
Formulado en 1925 por el físico austríaco Wolfgang Pauli, constituye aún hoy uno de los pilares de la mecánica cuántica.
Un ejemplo práctico
El átomo de litio tiene número atómico Z = 3.
Es decir, posee tres electrones.
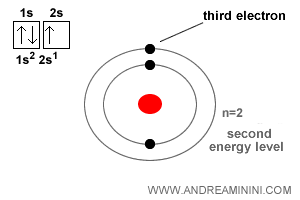
Los dos primeros electrones completan el orbital esférico más interno (1s), correspondiente al nivel de energía más bajo, n=1.
El tercero ocupa el siguiente orbital esférico (2s), asociado al nivel de energía n=2.
En los átomos, los electrones siempre llenan primero los orbitales disponibles de menor energía y, una vez ocupados, van progresivamente ocupando los de mayor energía.
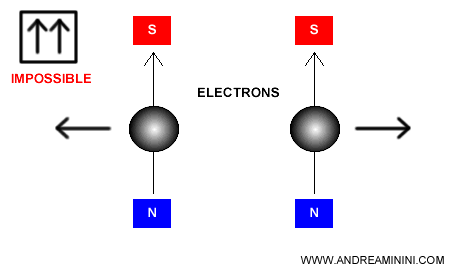
Nota. En un diagrama orbital, cada casilla representa un orbital y cada flecha un electrón. La dirección de la flecha indica la orientación del espín - arriba o abajo - . Por ello, dentro de un mismo orbital nunca pueden aparecer dos flechas apuntando en la misma dirección (ambas hacia arriba o ambas hacia abajo).
Ejemplo 2
El átomo de berilio tiene número atómico Z = 4.
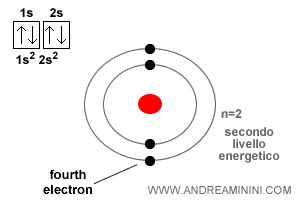
Los dos primeros electrones ocupan el orbital 1s, el más interno y de menor energía. El tercero entra en el orbital 2s, como sucede en el litio.
El cuarto electrón también se incorpora al orbital 2s, pero únicamente porque adopta el espín opuesto al ya presente.
Esto es, precisamente, lo que garantiza el principio de exclusión de Pauli: un orbital no puede albergar más de dos electrones y, cuando lo hace, sus espines deben ser opuestos.
Y así sucesivamente.