Principe de Pauli
Que dit exactement le principe de Pauli ?
Deux électrons ne peuvent partager une même orbitale que s’ils possèdent des spins opposés.
C’est pourquoi on l’appelle aussi le principe d’exclusion : il interdit à deux électrons d’occuper rigoureusement le même état quantique.
Comme le spin ne peut prendre que deux orientations possibles (↑ ou ↓), chaque orbitale atomique ne peut contenir au plus deux électrons.
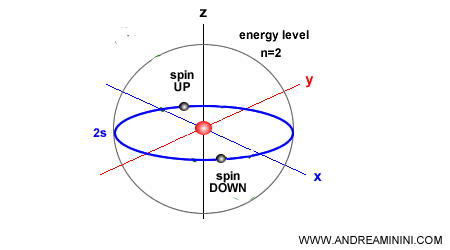
C’est pourquoi on parle parfois, de façon imagée, de la règle d’appariement des électrons.
Ce principe constitue l’une des règles fondamentales qui déterminent la configuration électronique des atomes.
Qu’est-ce que le spin ? Le spin est l’un des nombres quantiques fondamentaux de l’électron. Il représente une propriété intrinsèque de la particule qui ne peut prendre que deux valeurs : spin vers le haut (+½) ou spin vers le bas (−½). On le décrit souvent comme une rotation sur soi-même, mais il s’agit en réalité d’une grandeur strictement quantique, sans véritable équivalent classique.
De manière plus générale, le principe d’exclusion de Pauli s’applique à tous les fermions : des particules de spin demi-entier qui se répartissent dans des états quantiques antisymétriques.
Aucun couple de fermions identiques ne peut se trouver simultanément dans le même état quantique.
Ce principe dépasse donc le seul cas des électrons et concerne également les protons, les neutrons et l’ensemble des autres fermions.
Formulé en 1925 par le physicien autrichien Wolfgang Pauli, il reste aujourd’hui l’un des piliers de la mécanique quantique.
Un exemple concret
L’atome de lithium possède un numéro atomique $Z = 3$.
Il contient donc trois électrons.
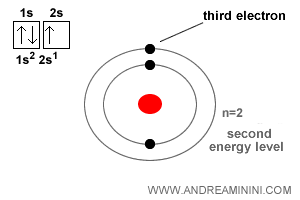
Les deux premiers électrons occupent l’orbitale sphérique la plus interne (1s), correspondant au niveau d’énergie le plus bas ($n=1$).
Le troisième se place dans l’orbitale suivante, également sphérique (2s), associée au niveau $n=2$.
Dans les atomes, les électrons remplissent toujours d’abord les orbitales les moins énergétiques, puis se répartissent progressivement dans celles de niveaux supérieurs.
Remarque. Dans un diagramme orbital, chaque case représente une orbitale et chaque flèche un électron. L’orientation de la flèche traduit le spin (↑ ou ↓). Ainsi, deux flèches pointant dans la même direction ne peuvent jamais coexister dans une orbitale donnée.
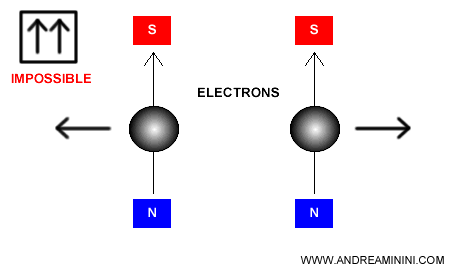
Exemple 2
L’atome de béryllium possède un numéro atomique $Z = 4$.
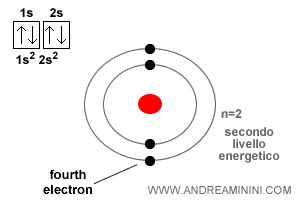
Les deux premiers électrons se logent dans l’orbitale 1s, la plus interne et la moins énergétique. Le troisième rejoint l’orbitale 2s, comme dans le cas du lithium.
Le quatrième électron s’y ajoute également, mais uniquement en adoptant un spin opposé à celui déjà présent.
C’est exactement ce qu’énonce le principe d’exclusion de Pauli : une orbitale ne peut contenir plus de deux électrons et, lorsqu’ils sont deux, leurs spins doivent être antiparallèles.
Et l’on peut poursuivre ainsi avec des atomes de plus en plus complexes.